Super-resolution 3D live-cell imagingとは?生きた細胞のナノスケール可視化を実現するAI技術
Super-resolution 3D live-cell imagingとは?生きた細胞のナノスケール可視化を実現するAI技術
生きた細胞の内部構造をリアルタイムで観察し、分子レベルの動態を解明する技術が急速に発展しています。従来の光学顕微鏡では捉えることができなかった微細な構造や、細胞内で起こる複雑な現象を、AI技術の力によって可視化できるようになりました。この記事では、Super-resolution 3D live-cell imaging(超解像3Dライブセルイメージング)という革新的な技術について、その基本原理からAIによる最新の進歩までを解説します。
Super-resolution 3D live-cell imagingとは
光学顕微鏡には「回折限界」という物理的制約があります。これは約250nm以下の構造を分解できないという物理的限界で、細胞内の微細な構造や分子の動きを詳細に観察することを困難にしていました[1]。しかし、1990年代以降、この回折限界を突破する超解像技術が次々と開発され、現在では10-20nmレベルの分解能を実現できるようになっています。
超解像技術の進歩により、生きた細胞をリアルタイムで観察しながら、その内部で起こる分子レベルの現象を捉えることが可能になりました。特に3Dイメージング機能は、分子のダイナミクスと相互作用をその環境の完全なコンテキスト内で理解するためにますます重要になっています[1]。従来の2D観察では見落とされがちだった立体的な構造変化や、細胞内小器官の3次元的な配置関係を詳細に解析できるようになったのです。
この技術は、神経科学におけるシナプス形成の観察、がん研究での細胞浸潤過程の追跡、創薬研究における薬剤効果の評価など、様々な生命科学研究分野で重要な役割を果たしています。生きた細胞を傷つけることなく、自然な状態での細胞の挙動を観察できることは、生物学研究における大きなブレイクスルーと言えるでしょう。
従来法の課題:なぜAIが必要なのか
従来の超解像顕微鏡技術には、いくつかの重大な課題がありました。まず、高解像度を実現するために長時間の露光が必要で、これが細胞に光毒性を与えてしまう問題です。生きた細胞を観察する際、細胞の健康を保つためには光量を抑える必要がありますが、そうすると画像が暗くなり、ノイズが増加してしまいます。この光毒性と解像度の間のトレードオフは、長い間研究者を悩ませてきました。
また、3D超解像アプローチは取得速度によって依然として大幅に制限されており、この制限は現在のところディープラーニングアプローチを実装することによってのみ克服されています[1]。従来の方法では、3次元の情報を取得するために多数の焦点面を順次撮影する必要があり、これには膨大な時間がかかっていました。さらに、取得された大量のデータを処理し、意味のある情報を抽出する作業も、人間の手作業では限界がありました。
顕微鏡ハードウェアの最適化で一部の課題は対処できますが、物理的限界は簡単に克服できません[2]。例えば、回折限界は光の波長によって決まる物理法則であり、光学系の改良だけでは根本的な解決には至りません。また、撮影速度と解像度、光毒性の間には本質的なトレードオフが存在し、ハードウェアの改良だけでは全ての要求を同時に満たすことは困難でした。
これらの課題を解決するために、AI技術、特にディープラーニングが重要な役割を果たすようになりました。AIは、低品質の画像から高品質な画像を復元したり、少ない情報から3次元構造を推定したり、ノイズを除去して信号を強調したりする能力を持っています。これにより、細胞に優しい条件で撮影しながらも、従来では不可能だった高解像度での観察が実現できるようになったのです。
多様なAI技術による画像復元と超解像
CARE
CARE(Content-Aware Image Restoration)は、ディープラーニングに基づく画像復元技術の代表例です。この技術を蛍光顕微鏡画像に適用し画像復元すると、より高いフレームレート、より短い露光、およびより低い光強度で観察でき、より高い分解能に到達し、それによって下流解析を改善できることを実証しています[2]。
図1は核染色されたプラナリア(扁形動物)の入力データとCAREによる復元結果です。上段は生の入力画像、中段はCAREによる画像復元結果、下段は固定サンプルから得たゴールドスタンダード画像です[2]。
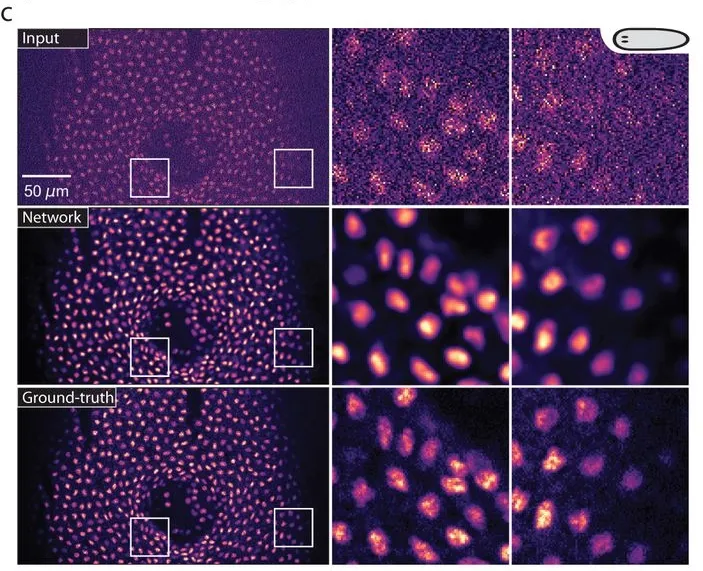 図1. 蛍光顕微鏡におけるCARE[2]
図1. 蛍光顕微鏡におけるCARE[2]
CAREの驚異的な能力は、取得時に60分の1の光子しか使用されなくても顕微鏡画像を復元できることです[2]。細胞に極めて優しい条件で撮影しながらも、従来と同等またはそれ以上の解像度を実現できます。また、3D撮影において、従来なら10枚必要だったZ軸方向の画像を1枚で済ませながら、X、Y、Z軸すべてで同じレベルの解像度を達成できます。さらに、回折限界より小さい管状および顆粒状構造を、従来の手法と比べて20倍速い速度で撮影しながらも高解像度で観察できます[2]。
CAREの技術的革新は、3つの異なるデータ生成方法で実現されています。物理的データでは、同じサンプルを異なる光量で撮影した画像ペアを使用してネットワークを訓練します。半合成データでは、既存の高品質画像を計算的に劣化させて訓練データを生成します。合成データでは、完全に人工的に生成した画像ペアを使用して、現実の顕微鏡データに適用可能なモデルを構築します。
eSRRF
eSRRF(enhanced Super-Resolution Radial Fluctuations)は、2023年に発表された最新の超解像技術です。SRRF(Super-Resolution Radial Fluctuations)はもともとAIとは独立した数理的超解像法でしたが、eSRRFでAIが統合され、ライブセル3D超解像を現実的に加速させました[3]。
従来のSRRFは「パラメータ選択次第で結果が大きく変わる」という欠点がありました。eSRRFでは、AIがそのパラメータを探索・最適化し、より安定で高忠実度の3Dライブセル超解像を可能にしています[3]。従来のSRRF法と比較して画像の忠実度と解像度を大幅に向上させ、データ自体に基づく自動パラメータ最適化を組み込んでいます。
特に注目すべきは、多焦点顕微鏡法と組み合わせることで、eSRRFを3次元に拡張したことです。これにより、1秒あたり約1体積の取得速度で、生細胞の体積超解像画像化を実現しました[3]。この技術により、生細胞で高速2Dおよび3D超解像イメージングが実現されました。
図2は多焦点顕微鏡とeSRRFによる3D live-cell超解像画像で、aがeSRRF処理前、bが処理後です[3]。
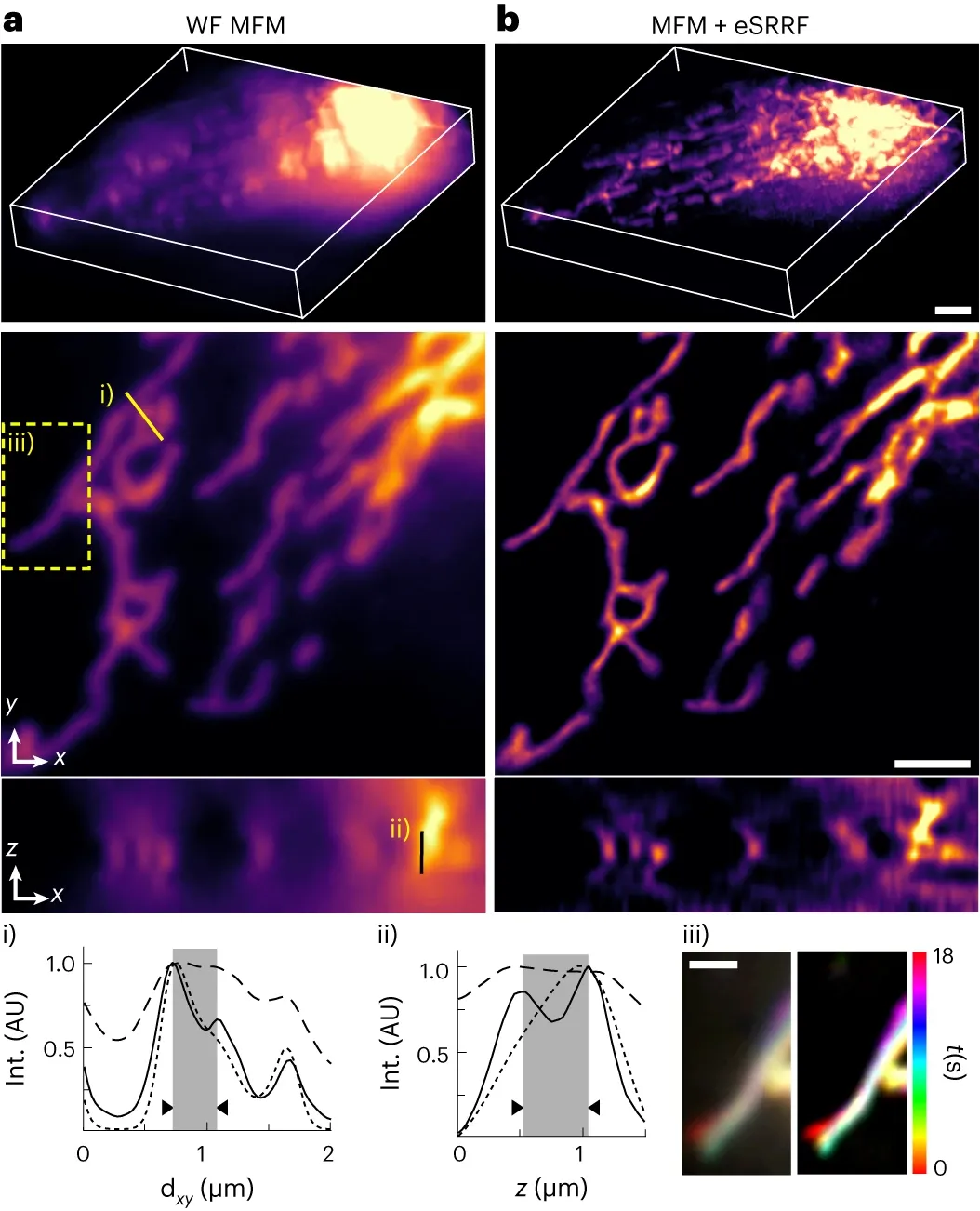 図2. 多焦点顕微鏡とeSRRFによる3D live-cell超解像画像[3]
図2. 多焦点顕微鏡とeSRRFによる3D live-cell超解像画像[3]
eSRRFの技術的優位性は、SQUIRRELエンジンを統合した自動パラメータ探索にあります。このシステムは、データ自体に基づいて最適な再構築設定を自動的に探索し、解像度と忠実度の間のトレードオフをユーザーに提示します。これにより、ユーザーバイアスを最小限に抑えた、再現性の高い超解像画像の取得が可能になりました。
Nikonの顕微鏡システムで活用されるAI技術
実際の研究現場では、学術的な技術だけでなく、商用顕微鏡システムに組み込まれたAI技術も広く活用されています。Nikonの顕微鏡システムではAI技術が実装されており、ライブセルイメージングの品質向上に大きく貢献しています[4]。
Convert.aiは、明視野画像から蛍光画像の特徴を予測する技術です。例えば、DIC画像から核の染色パターンを予測することで、強い光を当てる蛍光観察を避け、細胞に優しい撮影が可能になります[4]。
Enhance.aiは、蛍光シグナルの弱い画像から、高いS/N比の画像を構築する技術です。S/N比(信号対雑音比)とは、有用な信号とノイズの比率を示す指標で、この値が高いほど画像が鮮明になります。この技術により、細胞に優しい弱い光で撮影した画像でも、従来では見えなかった微細な構造を鮮明に観察できるようになります[4]。
Denoise.aiは、画像のノイズをリアルタイムで除去する技術です。高速撮影時でも鮮明な画像を維持でき、生きた細胞の動きを滑らかに観察できます[4]。
研究への影響:Super-resolution 3D live-cell imagingの未来
AIの導入によって、Super-resolution 3D live-cell imaging技術の可能性は劇的に変化しました。従来は不可能だった、生きた細胞でのナノスケール観察が現実のものとなり、基礎研究から応用研究まで幅広い分野で革新的な発見が生まれています。
基礎研究においては、細胞内動態の理解が飛躍的に進歩しました。例えば、ミトコンドリアのネットワーク形成過程、エンドソームの移動経路、細胞骨格の動的再構築など、これまで推測に頼っていた現象を直接観察できるようになりました。これらの観察により、細胞内の分子メカニズムに関する新たな仮説が生まれ、より精密な実験設計が可能になっています。
応用研究では、創薬や疾患モデル解析への応用が急速に進んでいます。薬剤が細胞内でどのように作用するかをリアルタイムで観察できるため、より効果的な薬剤の開発が期待されています。また、がん細胞の浸潤過程や、神経変性疾患における細胞死のメカニズムなど、疾患の理解を深める研究でも重要な役割を果たしています。
将来的には、「AI主導のセルフドライビング顕微鏡」の実現が期待されています[1]。この技術では、AIが画像をリアルタイムで解析し、興味深い現象を自動的に検出して、最適な撮影条件に調整します。これにより、研究者は実験の細かい調整に時間を費やすことなく、より多くの発見に集中できるようになるでしょう。
臨床応用においても、病理診断やオルガノイドモデル解析などへの応用が試験的に始まっています。将来的には、これらの技術がルーチン検査に組み込まれ、より精密で迅速な診断が可能になることが期待されています。
Super-resolution 3D live-cell imaging技術は、AI技術の進歩とともに、生命科学研究の新たな地平を切り開いています。生きた細胞の謎を解き明かすこの技術は、今後もさらなる発展を続け、人類の健康と福祉に大きく貢献していくことでしょう。
参考文献
-
Pylvänäinen, J. W. et al., “Live-cell imaging in the deep learning era”, Current Opinion in Cell Biology 85(2023):102271. https://doi.org/10.1016/j.ceb.2023.102271
-
Weigert, M. et al., “Content-aware image restoration: pushing the limits of fluorescence microscopy”, Nature Methods 15(2018):1090-1097. https://doi.org/10.1038/s41592-018-0216-7
-
Laine, R. F. et al., “High-fidelity 3D live-cell nanoscopy through data-driven enhanced super-resolution radial fluctuation”, Nature Methods 20(2023):1949-1956. https://doi.org/10.1038/s41592-023-02057-w
-
Nikon Healthcare, 「ライブセルイメージング」, 2025, Accessed:2025-10-01. https://www.microscope.healthcare.nikon.com/ja_JP/applications/life-sciences/live-cell-imaging
Contact
Science Aidは、研究を中心とした幅広い領域をAIによって支援します。システム開発やコンサルティング、共同研究、セミナーのご依頼などお気軽にご相談ください